我们的服务

注册质量体系核查服务
1. 质量体系核查要求
根据《医疗器械监督管理条例》的规定,第Ⅱ、Ⅲ类医疗器械生产企业在注册申报前需要完成《医疗器械生产质量管理规范》的考核,医疗器械生产企业在生产过程中要按照《医疗器械生产质量管理规范》的要求组织生产,否则将会被处罚。
2. 质量体系核查资料要求
| 质量体系服务流程 | 资料要求及确认工作 | 客户配合工作内容 | |
| 确定质量体系产品的范围 | 产品的名称 预期用途 工艺流程及关键控制点 | 提交相关产品资料 | |
| 申请前准备工作 | 人员及培训 | 1.生产企业负责人、生产、技术和质量管理部门负责人简历,学历和职称证书复印件; 2.生产企业组织机构图。 | 提供相关人员资料及企业资料 |
| 场地及设施 | 1. 《医疗器械生产企业许可证》副本和营业执照副本复印件 2.主要生产设备和检验设备目录。 3.生产无菌医疗器械的,应当提供由有资质的检测机构出具的一年内的生产环境检测报告(包括无菌检验室的检测报告)。 4.生产企业总平面布置图(包括无菌检测实验室)、生产区域分布图。 | 提供相应的场地及设施资料 | |
| 生产产品及生产工艺 | 1. 申请检查产品的医疗器械注册证书复印件(如有)、拟注册产品标准; 2. 工艺流程图 3. 产品注册型式检验报告(首次注册情况,报告需满足时限要求)和临床试验资料(首次注册情况,或者重新注册时改变产品适用范围的)原件。 | 提供相应生产产品及工艺资料 | |
| 质量管理体系文件 | 生产质量管理规范文件目录 | 提供质量管理体系文件 | |
| 自查自评 | 根据自查要求,提供质量管理体系自查评定表 | 配合自查自评 | |
| 质量体系考核申请 | 1. 填写《医疗器械生产质量管理规范检查申请表》 2. 根据以上资料要求,整理成册 | 核对及签章 | |
| 质量体系考核,资料审查及现场检查 | 配合资料补正及现场核查 | 配合现场核查 | |
| 质量体系考核报告取得 | 获得质量体系考核报告 | 获得质量体系考核报告 | |
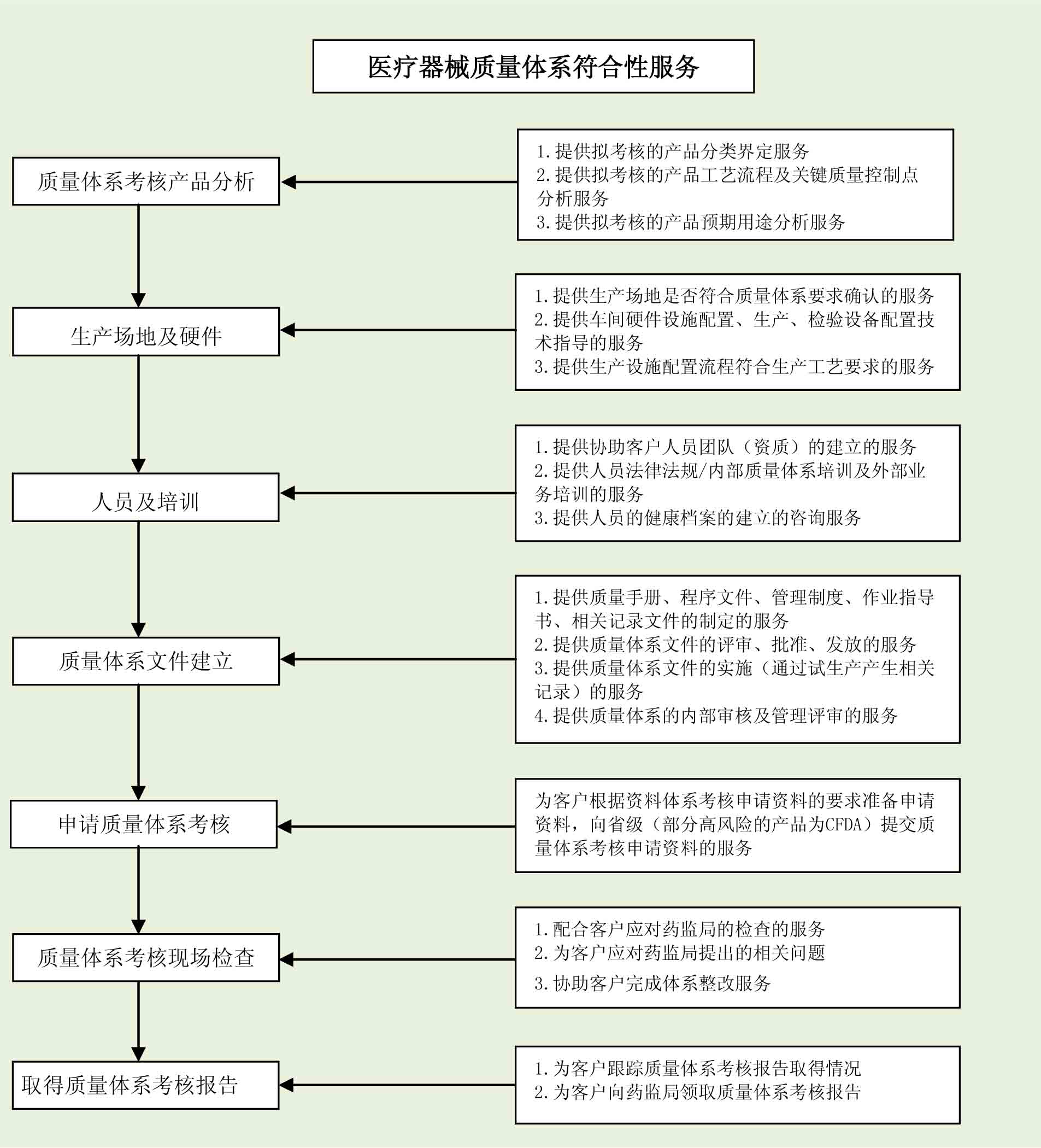
3. 服务流程
4. 服务内容
- 质量体系文件的起草及审核。
- 质量体系人员团队的建立及培训。
- 质量体系生产车间、生产设备等硬件的符合性审核。
- 质量体系建立及执行的培训指导。
- 质量体系考核资料准备、提交、跟踪直到通过核查并取得考核报告。
更多
收起
-
服务流程资料添加中....
- 官方收费资料添加中....
- 基础法规资料添加中....
- 相关服务资料添加中....



















 全国服务热线:
全国服务热线:
